Conheça as vacinas candidatas contra o coronavírus mais promissoras que existem
– A University of Oxford / AstraZeneca iniciou os testes de fase 3 nos Estados Unidos e interrompeu / retomou brevemente seus testes para investigar uma doença inexplicada.
– uma seção sobre Novavax. A empresa iniciou os testes de fase 3 no Reino Unido
– Resultados de Sinovac de um ensaio de fase 1 / fase 2 em participantes idosos
Usando materiais de vírus do resfriado enfraquecidos a fragmentos de código genético, cientistas em todo o mundo estão criando dezenas de candidatos a vacinas exclusivas para combater o novo coronavírus – e estão fazendo isso em velocidades sem precedentes.
Mais de sete meses depois que a Organização Mundial da Saúde (OMS) alertou o mundo sobre um misterioso grupo de casos de pneumonia em Wuhan, China, 187 vacinas candidatas estão em desenvolvimento para prevenir o coronavírus que causou a doença (chamado COVID-19), de acordo com QUEM . A maioria das vacinas candidatas está em estágios pré-clínicos, o que significa que ainda estão sendo testadas em animais ou no laboratório, mas 38 delas foram testadas em humanos.
Esses ensaios clínicos são divididos em três a quatro estágios, com os estágios anteriores (fase 1 / fase 2) examinando a segurança, dosagem e possíveis efeitos colaterais e eficácia (como funciona bem no combate ao patógeno) da vacina candidata em um pequeno grupo de pessoas, de acordo com a Food and Drug Administration (FDA) . A chave para obter a aprovação de uma vacina candidata, no entanto, é mostrar resultados promissores no ensaio de fase 3 mais avançado.
Nos ensaios de fase 3, os pesquisadores testam a eficácia da vacina, enquanto monitoram as reações adversas em centenas a milhares de voluntários. O FDA então aprova a vacina se os testes mostrarem que ela é segura e eficaz, e os benefícios da vacina superam seus riscos, de acordo com os Centros de Controle e Prevenção de Doenças (CDC) . Cinco vacinas candidatas contra o coronavírus começaram a recrutar, ou estão em fase de testes, de fase 3, de acordo com a OMS. Aqui estão os mais promissores desses candidatos:
Universidade de Oxford / AstraZeneca

A vacina atualmente chamada ChAdOx1 nCoV-19, popularmente conhecida como vacina Oxford, está sendo desenvolvida pela universidade britânica em colaboração com a empresa farmacêutica AstraZeneca. Um ensaio clínico de fase 3 que deve envolver cerca de 30.000 adultos começou nos EUA em 31 de agosto, de acordo com uma declaração do National Institutes of Health . Existem também estudos de fase 3 para ChAdOx1 nCoV-19 em andamento no Reino Unido e em outros países.
Em 6 de setembro, a AstraZeneca interrompeu seus testes depois que uma participante – uma mulher no Reino Unido – mostrou sintomas neurológicos frequentemente associados à mielite transversa, uma condição na qual a medula espinhal fica inflamada, de acordo com um relatório anterior da Live Science . Mas não ficou claro se a doença inexplicada foi devido à vacina ou se ocorreu no participante por acaso. Os testes foram retomados alguns dias depois, depois que a Autoridade Reguladora de Saúde de Medicamentos do Reino Unido disse que era seguro continuar, de acordo com a CNBC.
A vacina é feita a partir de uma versão enfraquecida de um vírus do resfriado comum, chamado adenovírus, que infecta chimpanzés. Os pesquisadores alteraram geneticamente o vírus para que não pudesse se replicar em humanos e adicionaram genes para codificar as chamadas proteínas de pico que o coronavírus usa para infectar células humanas. Em teoria, a vacina vai ensinar o corpo a reconhecer esses picos, de modo que, quando uma pessoa é exposta, o sistema imunológico pode destruí-la, de acordo com um relatório anterior da Live Science .
Os pesquisadores testaram anteriormente esta vacina em macacos rhesus e descobriram que ela não evitou que os macacos se infectassem quando deliberadamente expostos ao coronavírus, mas os impediu de desenvolver pneumonia , sugerindo que era parcialmente protetora, de acordo com um estudo publicado em 13 de maio para o banco de dados de pré-impressão BioRxiv .
Em abril, os pesquisadores começaram a testar a vacina em pessoas e publicaram os primeiros resultados de seus estudos de fase 1 e fase 2 ainda em andamento em 20 de julho na revista The Lancet . A vacina não causou efeitos adversos sérios nos participantes, mas provocou alguns efeitos colaterais leves, como dores musculares e calafrios. A vacina estimulou o sistema imunológico a produzir células T específicas para SARS-CoV-2 – um grupo de glóbulos brancos importantes na luta contra patógenos – e anticorpos neutralizantes , ou moléculas que podem se prender ao vírus e impedir que infecte células , De acordo com o relatório.
Os testes de fase 3 já começaram no Brasil e vão inscrever até 5.000 voluntários. Espera-se que outro ensaio de fase 3 inclua mais 10.500 pessoas no Reino Unido e 30.000 nos EUA, de acordo com a página do ensaio de vacinas Oxford e o The New York Times . A equipe de Oxford também expressou interesse em conduzir estudos de desafio em humanos, o que significa que eles infectariam deliberadamente voluntários de baixo risco com o vírus, seja ao longo dos testes de fase 3 ou depois de concluídos, de acordo com o The Guardian .
O Departamento de Saúde e Serviços Humanos (HHS) dos Estados Unidos anunciou que daria até US $ 1,2 bilhão à AstraZeneca para acelerar o processo de desenvolvimento da vacina e ajudar a empresa a fabricar pelo menos 300 milhões de doses da vacina – se ela se mostrar segura e eficaz – já em outubro de 2020, de acordo com um comunicado . Isso faz parte da operação Warp Speed da administração Trump, uma iniciativa que visa entregar 300 milhões de doses de uma vacina segura e eficaz até janeiro de 2021, de acordo com o HHS .
Sinovac Biotech
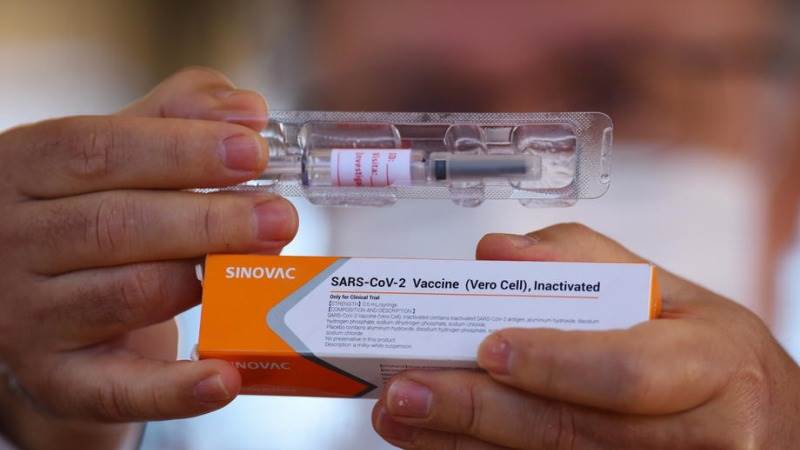
Outra vacina candidata, chamada CoronaVac, desenvolvida pela Sinovac Biotech de Pequim, protegeu macacos rhesus da infecção com o novo coronavírus, de acordo com um estudo publicado em 3 de julho na revista Science . A empresa, que já demonstrou que a vacina é segura e eficaz nos primeiros ensaios clínicos, está recrutando para um ensaio clínico de fase 3 com 8.870 participantes no Brasil, de acordo com o clinictrials.gov .
Esta vacina é composta por uma versão inativada do vírus SARS-CoV-2. As vacinas inativadas são a versão morta do patógeno que causa a doença (em oposição aos vírus enfraquecidos que são vacinas vivas), de acordo com o Departamento de Saúde e Serviços Humanos (HHS) dos Estados Unidos . Vírus inativados, como a vacina da gripe ou da hepatite A, normalmente não são tão protetores quanto as vacinas vivas e podem exigir doses de reforço ao longo do tempo, de acordo com o HHS. Em contraste, a vacina Oxford é uma forma enfraquecida de uma vacina viva, que pode criar respostas imunológicas duradouras, mas tende a ser mais arriscada para pessoas com sistema imunológico enfraquecido ou outros problemas de saúde, de acordo com o HHS.
Sinovac iniciou os ensaios de fase 1 / fase 2 (envolvendo 743 adultos saudáveis) em abril na província de Jiangsu, na China. Eles deram aos participantes duas doses da vacina, com duas semanas de intervalo, e relataram que a vacina não causou nenhum evento adverso sério, de acordo com um comunicado . Os autores do estudo também disseram que mais de 90% dos participantes desenvolveram anticorpos neutralizantes para a vacina duas semanas após receberem a segunda dose. No entanto, seus resultados foram relatados apenas em um comunicado à imprensa e ainda não foram publicados em um jornal revisado por pares. A empresa está conduzindo agora um ensaio de fase 2 em adultos idosos e, posteriormente, fará um em crianças e adolescentes, de acordo com outro comunicado. Sinovac já usou a mesma tecnologia para criar vacinas aprovadas para hepatite A, hepatite B e gripe suína, gripe aviária e o vírus que causa doenças nas mãos, febre aftosa, de acordo com o STAT News .
Em 9 de setembro, a Sinovac relatou resultados iniciais promissores de seu ensaio clínico de fase 1 / fase 2 em voluntários mais velhos, de acordo com um comunicado . O ensaio envolveu 421 voluntários saudáveis com idades entre 60 e 89 anos. A vacina não causou reações adversas graves e foi bem tolerada, disse a empresa no comunicado. Esses participantes desenvolveram níveis de anticorpos comparáveis aos do grupo de adultos de 18 a 59 anos, de acordo com a declaração; os resultados ainda não foram publicados em um jornal com revisão por pares.
A China aprovou esta vacina para uso emergencial (junto com duas outras vacinas desenvolvidas pela Sinopharm). Cerca de 90% dos funcionários da Sinovac e suas famílias tomaram a vacina experimental sob o programa de uso de emergência da China, informou a Reuters em 6 de setembro.
Moderna / Instituto Nacional de Alergia e Doenças Infecciosas
Esta vacina candidata (mRNA-1273), desenvolvida pela empresa americana de biotecnologia Moderna e o Instituto Nacional de Alergia e Doenças Infecciosas (NIAID), foi a primeira a ser testada em humanos nos EUA, de acordo com um relatório anterior da Live Science .
A vacina da Moderna conta com uma tecnologia que não foi usada em nenhuma vacina aprovada até agora: um pedaço de material genético chamado RNA mensageiro (mRNA). As vacinas tradicionais são feitas de vírus enfraquecidos ou inativos, ou proteínas desses vírus, para desencadear uma resposta imunológica; As vacinas de mRNA, por outro lado, são compostas de material genético que ensina as células a construir essas proteínas virais (no caso, a proteína spike do coronavírus). As vacinas tradicionais e de mRNA desencadeiam uma resposta imunológica no corpo de forma que, se uma pessoa for exposta naturalmente ao vírus, o corpo pode rapidamente reconhecê-lo e combatê-lo.
Essas vacinas de mRNA têm várias vantagens, incluindo serem mais rápidas e fáceis de fabricar do que as vacinas tradicionais, que podem levar tempo para se desenvolver porque os cientistas precisam cultivar e inativar patógenos inteiros ou suas proteínas, de acordo com a National Geographic . As vacinas de mRNA também podem ser mais duráveis contra patógenos que tendem a sofrer mutação, como coronavírus e vírus da gripe. No entanto, as vacinas de mRNA podem causar reações adversas no corpo; esses tipos de vacinas também têm problemas de estabilidade, quebrando muito rapidamente, o que pode limitar a força da imunidade, de acordo com a National Geographic.
As vacinas de mRNA mostraram ser “uma alternativa promissora” às vacinas tradicionais, mas “sua aplicação tem sido até recentemente restringida pela instabilidade e ineficiência” na entrega no corpo, um grupo de pesquisadores relatou em uma revisão de 2018 publicada na revista Nature Reviews Drug Discovery . “Os recentes avanços tecnológicos superaram amplamente esses problemas, e várias plataformas de vacinas de mRNA contra doenças infecciosas e vários tipos de câncer demonstraram resultados encorajadores em modelos animais e humanos.”
Em 14 de julho, a Moderna publicou os primeiros resultados promissores de um estudo de fase 1 composto por 45 participantes no The New England Journal of Medicine . Os participantes foram divididos em três grupos e receberam uma dose baixa, média ou alta da vacina. Depois de receber duas doses da vacina, todos os participantes desenvolveram anticorpos neutralizantes em níveis acima da média daqueles encontrados em pacientes COVID-19 recuperados, relatou a Live Science .
A vacina parecia segura e geralmente bem tolerada, mas mais da metade dos participantes teve alguns efeitos colaterais (semelhantes aos efeitos colaterais que podem acontecer com a vacina anual contra a gripe), incluindo fadiga, calafrios, dor de cabeça, dores musculares e no local da injeção . Alguns participantes nos grupos de dose média e alta tiveram febre após a segunda injeção. Uma pessoa que recebeu a dose mais alta teve febre “severa”, náusea, tontura e um episódio de desmaio, de acordo com o relatório. Mas este participante se sentiu melhor depois de um dia e meio. Essas altas doses não serão administradas aos participantes dos próximos ensaios.
O teste de fase 2 da Moderna ainda está em andamento e, em 27 de julho, a empresa iniciou seu teste de fase 3 nos Estados Unidos, de acordo com um relatório da Live Science . O teste deve inscrever cerca de 30.000 participantes até o final do verão – e os primeiros resultados do teste podem estar disponíveis em novembro, de acordo com o relatório.
Em abril, o HHS, sob a Operação Warp Speed, se comprometeu a gastar até US $ 483 milhões para o desenvolvimento acelerado da vacina da Moderna.
Em 28 de julho, os cientistas publicaram um novo artigo no The New England Journal of Medicin edetalhando como a vacina da Moderna induziu uma forte resposta imunológica em macacos rhesus. Depois de receber uma dose de 10 ou 100 μg da vacina e, em seguida, uma segunda dose duas semanas depois (alguns não receberam a vacina e serviram como um ponto de comparação), os macacos foram “desafiados” ou expostos ao coronavírus na semana 8. Os pesquisadores descobriram que os macacos desenvolveram uma forte resposta imunológica ao vírus, pois seu sistema imunológico produzia anticorpos neutralizantes e células T. Dois dias depois que os macacos foram expostos ao coronavírus, os pesquisadores não conseguiram detectar nenhuma replicação viral no nariz ou nos pulmões, sugerindo que a vacina protegeu contra a infecção precoce. (Isso está em contraste com o estudo da Universidade de Oxford conduzido em macacos, que parecia impedir os macacos de desenvolver pneumonia, mas não
CanSino Biologics / Instituto de Biotecnologia de Pequim
A CanSino Biologics, em colaboração com o Instituto de Biotecnologia de Pequim, desenvolveu uma vacina candidata usando um adenovírus enfraquecido. Ao contrário da vacina Oxford, que depende de um adenovírus que infecta chimpanzés, a CanSino Biologics está usando um adenovírus que infecta humanos.
Junto com a Moderna, este grupo também publicou os resultados de seu ensaio de fase 2 em 20 de julho na revista The Lancet . O ensaio, que foi conduzido em Wuhan (onde os primeiros casos de coronavírus surgiram), envolveu 508 participantes que foram designados aleatoriamente para receber uma das duas doses diferentes da vacina ou um placebo.
Este estudo também não encontrou eventos adversos graves, embora alguns relataram reações leves ou moderadas, incluindo febre, fadiga e dor no local da injeção. Cerca de 90% dos participantes desenvolveram respostas de células T e cerca de 85% desenvolveram anticorpos neutralizantes, de acordo com o estudo.
“Os resultados de ambos os estudos são um bom augúrio para os ensaios de fase 3, onde as vacinas devem ser testadas em populações muito maiores de participantes para avaliar sua eficácia e segurança”, Naor Bar-Zeev e William J. Moss, ambos parte da John Hopkins ‘International Vaccine Access Center, escreveu em um comentário no The Lancet referindo-se a este estudo e ao estudo da vacina Oxford publicado na mesma revista. “No geral, os resultados de ambos os ensaios são bastante semelhantes e promissores.”
Eles agora estão procurando conduzir um teste de fase 3 fora da China, de acordo com a Reuters . Em junho, a vacina contra o coronavírus CanSino recebeu aprovação para ser usada nas forças armadas da China, de acordo com a Reuters .
Sinopharm
A vacina candidata do Grupo Farmacêutico Nacional da China (Sinopharm) é uma forma inativada do SARS-CoV-2. Em 13 de agosto, a empresa publicou dados de seus ensaios clínicos de fase 1 e fase 2 no jornal JAMA . No estudo de fase 1, 96 adultos saudáveis foram aleatoriamente designados para receber uma dose baixa, média ou alta da vacina ou para receber hidróxido de alumínio como placebo. Eles receberam a segunda e a terceira doses da vacina (ou o placebo) após 28 dias e 56 dias, respectivamente.
Os pesquisadores descobriram que a vacina acionou seus corpos para produzir anticorpos neutralizantes. Nos participantes que receberam o placebo, 12,5% tiveram reações adversas. Naqueles que receberam vacinas de baixa, média e alta dose, 20,8%, 16,7% e 25% tiveram reações adversas leves, respectivamente, de acordo com o estudo. No ensaio de fase 2, 224 adultos receberam uma dose média ou um placebo e, em seguida, uma segunda injeção 14 dias ou 21 dias após a primeira. Novamente, os participantes desenvolveram anticorpos neutralizantes e relataram algumas reações adversas leves. A reação adversa mais comum foi dor no local da injeção e, em seguida, febre baixa. “Nenhuma reação adversa séria foi observada”, escreveram os autores.
A empresa já começou seu teste de fase 3 em Abu Dhabi, que vai recrutar até 15.000 pessoas, de acordo com a Reuters . Os participantes receberão uma das duas cepas da vacina ou um placebo, de acordo com a Reuters. A empresa também lançou testes de fase 3 no Peru e no Marrocos, de acordo com a Reuters .
A Sinopharm está testando uma segunda vacina desenvolvida pelo Instituto de Produtos Biológicos de Pequim em um ensaio de fase 3 nos Emirados Árabes Unidos e na Argentina.
Centenas de milhares de cidadãos chineses já foram vacinados por uma das duas vacinas da Sinopharm em um programa de uso de emergência, de acordo com Vox . Os Emirados Árabes Unidos concederam aprovação de emergência em 14 de setembro para a vacina contra o coronavírus da Sinopharm para profissionais de saúde da linha de frente (não está claro se eles aprovaram ambos ou um deles), de acordo com a Reuters .
Pfizer / BioNTech / Fosun Pharmaceutical
A Pfizer e a empresa de biotecnologia alemã BioNTech estão, como a Moderna, desenvolvendo uma vacina que usa RNA mensageiro para fazer o sistema imunológico reconhecer o coronavírus.
Em 27 de julho, a Pfizer e a BioNTech anunciaram o início de seus ensaios de fase 2 / fase 3 que inscreverão até 30.000 participantes e serão conduzidos em cerca de 120 locais em todo o mundo, incluindo nos EUA. Se a vacina for comprovada como segura e eficaz nesses testes, as empresas dizem que vão “buscar uma revisão regulatória” já em outubro; se a vacina for aprovada ou autorizada, eles fornecerão até 100 milhões de doses até o final de 2020 e cerca de 1,3 bilhão de doses até o final de 2021, segundo o comunicado. Em 12 de setembro, as empresas anunciaram que submeteram um “protocolo emendado” à Food and Drug Administration dos EUA para expandir seu teste de fase 3 para até 44.000 pessoas.
A vacina não causou nenhum evento adverso sério e pode estimular uma resposta imunológica, de acordo com os dados iniciais da fase 1 / fase 2 liberados para o banco de dados de pré-impressão medRxiv em 1º de julho e que ainda não foram revisados por pares. O estudo envolveu 45 pacientes que receberam uma das três doses da vacina candidata ou de um placebo. Nenhum dos pacientes apresentou efeitos colaterais graves, mas alguns desenvolveram efeitos colaterais, como febre (75% no grupo de dose mais alta), fadiga, dores de cabeça, calafrios, dores musculares e nas articulações.
Os pesquisadores descobriram que a vacina levou o sistema imunológico a produzir anticorpos neutralizantes em níveis 1,8 a 2,8 vezes maiores do que aqueles encontrados em pacientes recuperados, de acordo com o estudo. Mais tarde, a Pfizer anunciou novos resultados (em um comunicado à imprensa , para que as descobertas não sejam revisadas por pares) de que a vacina também estimulou a produção de células T específicas para o novo coronavírus.
Esta semana, a administração de Trump anunciou um contrato de US $ 1,95 bilhão com a Pfizer e BioNTech para produzir pelo menos 100 milhões de doses de sua vacina até o final do ano, se ela se provar segura e eficaz (com até 500 milhões de doses a mais, conforme necessário) . Os americanos receberiam a vacina gratuitamente, de acordo com o The New York Times . Anteriormente, as duas empresas anunciaram um acordo com o Reino Unido para 30 milhões de doses da vacina candidata se ela funcionar e for aprovada, segundo um comunicado .
A Pfizer está planejando um ensaio de fase 3 em grande escala para começar este mês e uma revisão regulatória já em outubro, de acordo com o Times.
Janssen Pharmaceutical Companies da Johnson & Johnson
A Johnson & Johnson iniciou os testes de fase 3 nos EUA em 23 de setembro, de acordo com um comunicado da empresa . O ensaio vai inscrever até 60.000 voluntários nos EUA, Brasil, Chile, Colômbia, México, Peru, Filipinas, África do Sul e Ucrânia, de acordo com ClinicalTrials.gov . O início deste estudo segue “resultados provisórios positivos” em relação à segurança e eficácia do estudo clínico de fase 1 / fase 2, que foi submetido ao medRxiv e “deve ser publicado online em breve”, escreveu a empresa no comunicado. Se a vacina se mostrar segura e eficaz, a empresa “antecipa que os primeiros lotes de uma vacina COVID-19 estarão disponíveis para autorização de uso de emergência no início de 2021”, de acordo com o comunicado.
A vacina experimental Janssen COVID-19 da Johnson & Johnson, chamada Ad26, é desenvolvida a partir de um adenovírus enfraquecido e é administrada a voluntários em dose única. A empresa está planejando conduzir outro ensaio de fase 3, em colaboração com o governo do Reino Unido, para testar duas doses, de acordo com a CNN . Este tipo de vacina é chamada de vacina baseada em vetor porque usa um vírus enfraquecido (um vetor) para entregar informações sobre o patógeno ao corpo para estimular a resposta imunológica. Neste caso, o adenovírus enfraquecido expressa a proteína “pico” SARS-CoV-2. A Janssen está usando a mesma tecnologia usada para desenvolver sua vacina contra o Ebola .
Os pesquisadores relataram em 30 de julho na revista Nature que uma única injeção da vacina Ad26 protegeu macacos rhesus da infecção com SARS-CoV-2. Neste estudo, os cientistas testaram sete tipos ligeiramente diferentes de protótipos de vacina Ad26 e identificaram aquele que produzia o maior número de anticorpos neutralizantes. Depois de receber a variante escolhida, os macacos foram expostos ao coronavírus. Seis dos sete macacos que receberam o protótipo da vacina, chamada Ad26.COV2.S, e depois expostos ao coronavírus, não apresentaram vírus detectáveis no trato respiratório inferior e um apresentou níveis muito baixos no nariz, de acordo com o comunicado.
O ensaio clínico de Fase 1/2 da Johnson & Johnson de Ad26.COV2.S envolveu cerca de 1.045 participantes saudáveis com idades entre 18 e 55 e aqueles com mais de 65 anos. A Johnson & Johnson anunciou recentemente um acordo de US $ 1 bilhão com o governo dos EUA para entregar 100 milhões de doses da vacina nos Estados Unidos se ela receber aprovação ou autorização de uso de emergência da Food and Drug Administration dos EUA, de acordo com um comunicado .
Novavax
A Novavax, empresa norte-americana de desenvolvimento de vacinas, está desenvolvendo uma vacina candidata contra o coronavírus chamada NVX-CoV2373. Chamada de “vacina de nanopartículas recombinantes”, ela é composta por várias proteínas de pico SARS-CoV-2 que são combinadas em uma nanopartícula junto com um composto de reforço imunológico chamado de adjuvante, de acordo com o The New York Times .
A empresa, que não lançou uma vacina no mercado em seus 33 anos de história, fez um acordo de US $ 1,6 bilhão com o governo dos Estados Unidos sob a Operação Warp Speed, de acordo com o Times. Em 2 de setembro, os primeiros resultados promissores dos ensaios de fase 1 / fase 2 da Novavax foram publicados no The New England Journal of Medicine .
Os ensaios envolveram 131 adultos saudáveis: oitenta e três dos participantes receberam a vacina com o adjuvante; 25 receberam a vacina sem o adjuvante; e 23 receberam o placebo. Os participantes receberam duas doses da vacina com 21 dias de intervalo. “Nenhum evento adverso sério foi observado”, escreveram os pesquisadores. Um participante teve uma febre leve que durou um dia, de acordo com o jornal.
Trinta e cinco dias após a dose inicial, os participantes que receberam a vacina apresentaram respostas imunes que excederam as dos pacientes que se recuperaram do COVID-19. Todos os participantes desenvolveram anticorpos neutralizantes em níveis de quatro a seis vezes maiores do que a média desenvolvida por pacientes recuperados, de acordo com a CNN . Em 16 participantes, que foram testados aleatoriamente, a vacina parecia gerar respostas de células T (as células T são um grupo de glóbulos brancos importantes na luta contra patógenos). “A adição de adjuvante resultou em respostas imunológicas aumentadas”, escreveram os autores.
Com base nesses resultados de segurança da fase 1, a empresa iniciou o ensaio de fase 2 do estudo . A empresa também iniciou um estudo separado de fase 2 na África do Sul, testando sua vacina candidata COVID-19 em voluntários HIV-negativos e HIV-positivos. Em 24 de setembro, a Novavax anunciou que iniciou sua fase 3 de testes da vacina no Reino Unido e vai inscrever até 10.000 voluntários.
Com Informações Live Science